Анализ нитритов и нитратов реактивом Грисса
Ештокин В.И.
Не раз мне приходилось сталкиваться с химиками, считающими что реактивом Грисса можно определять нитриты и нитраты. На счет определения нитритов я согласен, а что касается нитратов...
Обратимся к основным учебникам Аналитической химии. Так, В.Н. Алексеев [1] в разделе определения нитрит ионов описывает методику анализа реактивом Грисса-Илосвая и в этом же разделе имеется абзац: В отсутствие иона NO2- эта реакция может быть с успехом применена для открытия иона NO3- после восстановления его цинковой пылью в присутствии CH3COOH и дается ссылка на раздел определения нитрат иона, где описан химизм восстановления нитрата до нитрита.
Следовательно, определение нитратов и нитритов реактивом Грисса возможно только после восстановления нитратов до нитритов а не как нитрата иона!
Причем, при изучении литературы по этому вопросу хотелось бы отметить еще несколько интересных моментов. Во первых, что реактив Грисса постепенно развился в метод Грисса, позволяющий определять нитрит ионы количественно и во вторых, что для анализа можно использовать не только сульфаниловую кислоту и 1-нафтиламин.
Рассмотрим поподробнее химизм этой качественной реакции. Итак, в ее основе лежит реакция диазотирования сульфаниловой кислоты.
В [2] так описывается схема реакции диазотирования:
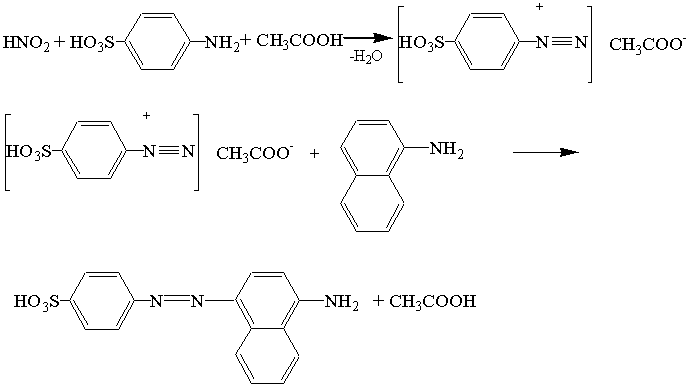
Причем продукт образующийся с 1-нафтиламином имеет более интенсивную окраску и естественно, реактив более чувствителен.
Нужно отметить, что не только реактив Грисса необходимо хранить в холодильнике, но и саму реакцию следует проводить при температуре 5 0С. При низкой температуре не происходит разложения соли диазония.
Тут же приведен механизм реакции определения нитритов с сульфаниловой кислотой и 2-нафтолом.
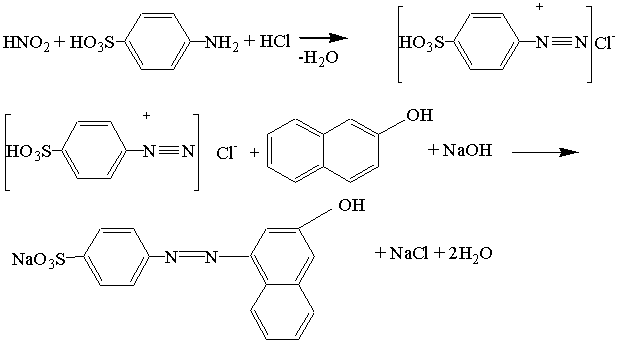 Как видно из условий реакции, диазотирование может проходить не только в сильнокислой среде, но и в щелочной. Однако данный метод (с 2-нафтолом) не совсем удобен, так как при нейтрализации соляной кислоты гидрооксидом натрия, происходит выделение тепла, которое может разрушать образовавшуюся соль диазония.
Как видно из условий реакции, диазотирование может проходить не только в сильнокислой среде, но и в щелочной. Однако данный метод (с 2-нафтолом) не совсем удобен, так как при нейтрализации соляной кислоты гидрооксидом натрия, происходит выделение тепла, которое может разрушать образовавшуюся соль диазония.
Помимо этих двух реакций в литературе описываются различные реактивы, заменяющие как сульфаниловую кислоту, так и 1-нафтиламин [3].
И это в основном связано с заменой в методе Грисса 1-нафтиламина, имеющего канцерогенные свойства. Так предложено несколько заменителей: 1-нафтиламин-7-сульфокислота (кислота Клеве), N-1-нафтилэтилендиамин, диметил-1-нафтиламин. Вместо сульфаниловой кислоты можно применять сульфаниламид.
Количественное определение нитритов основано на спектрофотометрии образующегося красителя в видимой и ультрафиолетовой части спектра, так как образующийся азокраситель имеет оптическую плотность, пропорциональную концентрации нитрит ионов. На основе этого разработаны и используются автоматические анализаторы нитратов-нитритов в воде, почве и т.д. (правда определение концентрации нитратов и нитритов происходит в сумме, т.е. нитраты тоже восстанавливаются на кадмии, и получается суммарный результат).
Как мы видим, метод Грисса прекрасно подходит для качественного и количественного определения нитритов, однако для определения нитратов, их необходимо восстанавливать. Однако здесь имеется небольшая проблема: при избытке восстановителя возможно нитраты восстановить до аммиака, который уже определяется Реактивом Неслера.
Как же все-таки определять наличие нитритов и нитратов при их совместном присутствии.
На мой взгляд, их определение необходимо проводить раздельно: нитриты - Реактивом Грисса-Илосвая, нитраты - дифениламином. Но это можно делать только как экспресс-метод, так как нитриты и нитраты довольно реакционноспособные и постоянно превращаются друг в друга под действием окружающих факторов. Так, например нитриты, образовавшиеся при выстреле, через незначительное время (несколько часов) переходят в нитраты, а растворы нитратов, содержащие или контактирующие с восстановителями (например цинком, алюминием), постепенно переходят в нитриты.
Да и сама реакция нитратов с дифениламином имеет совершенно другой химизм - в основном окисление дифениламина азотной кислотой.
 Причем указывается, что реакция идет и с нитритами, но как показывает опыт, при низких концентрациях нитрит ионы не дают реакции с дифениламином.
Причем указывается, что реакция идет и с нитритами, но как показывает опыт, при низких концентрациях нитрит ионы не дают реакции с дифениламином.
Еще одним из надежных методов служит реакция нитратов с хромотроповой кислотой в концентрированной серной кислоте.
Поэтому достаточно достоверно определить нитраты-нитриты при совместном присутствии, можно только используя инструментальные методы на основе спектрофотометрии.
Литература
- В.Н. Алексеев Курс качественного химического полумикроанализа. М.:- Госхимиздат, 1962 - 584 с.
- Крамаренко В.Ф. Токсикологическая химия.-К.: Вища шк. 1989 - 447с.
- Уильямс У.Дж.Определение Анионов: Справочник. Пер. с англ.-М.: Химия, 1982 - 624с.